El número necesario para vacunar (NNV) se utiliza como un cálculo resumido simple para evaluar los posibles beneficios de los programas de inmunización en la prevención y el control de enfermedades transmisibles. Para muchos puede ser utilizado como un sucedáneo, pero de igual calidad, del número necesario para tratar (NNT) en medicamentos. Se define como el número de personas necesarias para vacunar a fin de prevenir un resultado, y combina tanto la eficacia de la vacuna como la incidencia de la enfermedad. Generalmente, el NNV se calcula como NNV = 1/(incidencia anual del evento en los no vacunados × efectividad de la vacuna). Esto es equivalente a la recíproca de la reducción del riesgo absoluta anual, ya que la efectividad de la vacuna es comúnmente medida como la reducción del riesgo relativo.
Hashim et al publicaron una revisión sistemática en 2014 para responder: ¿Cómo y por qué los investigadores utilizaban el NNV? Ya que, pese a que el NNV es una medida intuitiva del beneficio de una vacuna dada, no existe un umbral acordado para interpretar este número, y se han planteado dudas sobre si es una medida adecuada Para ello comentaron al meno a 27 estudios primarios con el objetivo de explorar cómo y por qué se usa NNV en la literatura científica para sacar conclusiones sobre el uso apropiado de NNV para la toma de decisiones.
¿Cómo se utiliza el NNV en la literatura médica?
Aunque no es la forma habitual de presentación los resultados de efectividad algunos estudios los han publicado, algunos ejemplos:
Cerca de 1852 niños tendrían que vacunarse para evitar una hospitalización debido a cualquier cepa de influenza circulante en 2009. Lewis y sus colegas también cuantificaron la cantidad de niños que necesitaban vacunarse para evitar una hospitalización y una visita ambulatoria . Se encontró que el NNV varió de 1031 a 3050 para niños de 6 a 23 meses de edad y de 4,255 a 6,897 para niños de 24 a 59 meses de edad. Estimaron que entre 12 y 42 niños de 6 a 5 años de edad deben vacunarse para evitar una visita ambulatoria y que, por lo tanto, la vacunación es un medio importante para reducir las visitas ambulatorias asociadas con la influenza en este grupo de edad.
Voordouw et al investigaron el beneficio de la vacunación contra la influenza para prevenir la mortalidad por todas las causas. Los autores afirmaron que para prevenir una muerte por influenza se requiere vacunar a 302 personas o una por cada 195 vacunaciones con una cobertura vacunal de hasta el 74%. Llegaron a la conclusión de que la inmunización anual contra la gripe de la población de edad avanzada tiene el potencial de reducir la mortalidad por todas las causas. Aunque yo esté en desacuerdo con esta afirmación, pero lo que se quiere mostrar es la manera de presentar el NNV.
En otro estudio de Herpes Zoster, Brisson estimó el NNV para varios resultados de salud relacionados con Herpes Zoster para pacientes de 65 años. Brisson estimó que el NNV para prevenir un caso de Herpes Zoster es 11, para prevenir un caso de neuralgia posherpética (NPH) es 43, para prevenir una muerte por Herpes Zoster es 23,319, para prevenir un año de vida perdido es 3762 y para prevenir una el QALY (Quality Adjusted Life Expectancy Year o año de vida, ajustado por calidad) perdido es 165. El estudio indicó que, dado que el NNV para prevenir la pérdida de un QALY es significativamente menor que el NNV para prevenir la pérdida de un año de vida, el principal beneficio de la vacunación con Herpes Zoster sería entonces la prevención del dolor y el sufrimiento, en lugar de la mortalidad.
Se realizaron varios otros estudios para evaluar los beneficios de la vacunación contra otras enfermedades. Kelly et al. informaron un NNV de 646 para prevenir un caso de tuberculosis en 1986 y 551 en 1991. Llegaron a la conclusión de que esta evidencia respalda una política de vacunación neonatal continuada con Bacillus Calmette-Guérin (BCG) en la población de Irlanda. Un estudio del Reino Unido informó que 5,206 personas deben vacunarse para prevenir una enfermedad neumocócica invasiva. En este estudio, se comunicó la NNV como una forma alternativa de demostrar la eficacia general del programa de vacunación.
Un editorial de Sawaya y Smith calculó el NNV para un ensayo clínico (FUTURE II) que midió la eficacia de la vacuna contra el HPV. Se encontró que 129 personas necesitaban vacunarse contra el HPV para prevenir un caso de neoplasia intraepitelial cervical.
Dang et al. calculó el NNV para la enfermedad meningocócica del serogrupo B y estimó que entre 33 784 y 38,610 bebés necesitarían vacunarse para prevenir un caso de enfermedad meningocócica invasiva del serogrupo B. El número sería aún mayor, entre 123,751 y 141,429, si se supusiera que los casos en bebés menores de seis meses no se pueden prevenir con vacunas. Los autores concluyeron que esto era muy alto y hacía poco probable que la vacuna fuera una opción política atractiva. Dado que actualmente no existen vacunas meningocócicas B autorizadas en Canadá, los cálculos de este estudio se basaron principalmente en varias suposiciones, incluida la eficacia hipotética de la vacuna y la aceptación de la vacuna, y la suposición de que no no hubo inmunidad colectiva, lo que resultó en una estimación conservadora del NNV.
Crowcroft calculó la cantidad de hogares que deben vacunarse con la vacuna contra la hepatitis A en lugar de la inmunoglobulina humana normal para prevenir un caso de hepatitis A. El estudio encontró que se necesitaría vacunar entre 8 y 26 personas para prevenir un caso adicional. Seria interesante comparar ese número contra otra medida de salud pública como la provisión de agua potable, ya que todavía la provisión de esta no está generalizada en Argentina. Aunque claro está, la provisión de agua potable y cloacas previene muchas más enfermedades que una vacuna contra un solo germen.
Simoes et al realizaron una revisión sistemática y un metanálisis de ensayos clínicos de vacunas experimentales contra el VSR (Virus Sincial Respiratorio) para personas de 12 meses o más pero las conclusiones se vieron limitadas por la heterogeneidad entre los estudios.
Otros estudios utilizaron estos números para una evaluación económica, y asi valorar la rentabilidad. Pero no todos los médicos saben interpretar evaluaciones económicas. Aunque se puede decir, groseramente, que entre 1 y 3 PBI per cápita por año de vida ganado sería adecuado. Esto en Argentina sería entonces entre 8 y 24 mil dólares por año de vida ajustado por calidad de vida (QUALY).
Tres estudios identificados en la literatura midieron la rentabilidad de los programas de vacunación contra la tuberculosis. Trunz y sus colegas realizaron una revisión sistemática para evaluar la rentabilidad de los programas de inmunización infantil para prevenir la meningitis tuberculosa y la tuberculosis grave en todo el mundo. Estimaron que alrededor de 150,000 niños deberían ser vacunados para prevenir un caso de tuberculosis. Los autores comentaron que los programas de inmunización contra la tuberculosis son rentables para prevenir y controlar la tuberculosis infantil, especialmente en países con alta incidencia. En otro estudio en los Países Bajos, se estimó que se necesitaría vacunar alrededor de 9,000 para prevenir una infección tuberculosa grave. Presentaron sus resultados en términos de costo/DALY* a gastar en vacunación; El NNV para el grupo objetivo correspondió a 4,500 €/DALY, que, para los autores se encuentra por debajo del umbral considerado "razonable" , por lo que para los Países Bajos es rentable.
Por otro lado, Rahman et al. llevó a cabo un análisis de rentabilidad del programa japonés de vacunación con BCG. Este estudio estimó que se necesitarían entre 2,125 y 10,399 inmunizaciones a un costo de US $35,950–$175,862 para prevenir un caso de tuberculosis. Llegaron a la conclusión de que el programa de vacunación universal con BCG no es un enfoque rentable, ya que el costo de la inmunización fue mayor que el costo requerido para tratar a un paciente con infección tuberculosa.
Dos estudios han evaluado la rentabilidad utilizando NNV de una estrategia de inmunización "capullo" mediante la cual los padres y otros contactos cercanos de un bebé son vacunados contra el tétanos, la difteria y la tos ferina acelular, para proteger a los recién nacidos de la infección por tos ferina. Meregaglia et al. estimó que era necesario vacunar al menos a 5,000 padres, con un costo total de más de 100,000 €, para evitar una hospitalización relacionada con la tos ferina. Llegaron a la conclusión de que la estrategia del capullo de los padres no es un enfoque rentable para prevenir la tos ferina en este grupo de edad. Asimismo, Skowronski y sus colegas informaron que el NNV para la estrategia de inmunización capullo contra la tos ferina fue de alrededor de un millón para prevenir la muerte de un bebé y aproximadamente 10,000 para la hospitalización. Al igual que Meregaglia y sus colegas, describieron el programa de inmunización capullo como una estrategia no rentable. Es una lógica economicista, pero interesante de ver las cosas. Digamos que no siempre podemos medir las cosas por la alternativa más eficiente (vacuna vs. tratamiento de una enfermedad), pero lo que seguramente quieren resaltar los investigadores es el bajo rendimiento como medida de prevención.
Kelly y sus colegas realizaron un análisis de costo-efectividad para comparar los beneficios potenciales de los programas de vacunación contra la influenza y el neumococo en la población de edad avanzada. Aunque el costo de prevenir un caso de infección por influenza por año es menor que el costo de prevenir un caso de enfermedad neumocócica invasiva ($598 frente a $11 494), el costo de la prevención de una hospitalización por influenza y enfermedad neumocócica es similar en ambos programas ($10,787 y $11,494 respectivamente). El costo de la vacuna para prevenir una muerte por año es menor para el programa de vacunas contra el neumococo ($49,972 vs. $74,801). Dedujeron que dado que los costos de la vacuna asociados con la hospitalización o la muerte debido a la enfermedad neumocócica invasiva eran similares o más baratos que para la influenza, es probable que un programa de vacunas contra el neumococo también sea rentable en este grupo de edad.
Otros tres estudios demostraron la rentabilidad de las vacunas contra la gripe, el HPV y el Herpes Zoster. Brydak y sus colegas encontraron que 57 personas de la población anciana tendrían que vacunarse para prevenir un solo caso de influenza. Interpretaron sus hallazgos afirmando que la financiación de los programas de vacunación contra la gripe de rutina sería un enfoque muy rentable en esta población. Hillemanns y colegas informaron que un total de 120 niñas tendrían que vacunarse para prevenir un solo caso de cáncer de cuello uterino en Alemania y consideraron que el programa de vacunación contra el HPV era una estrategia rentable en comparación con la detección de cuello uterino solo. Finalmente, una evaluación de la rentabilidad de la vacuna Herpes Zoster y la neuralgia post herpética en ancianos en Bélgica encontró que el NNV es 12 para prevenir un caso de Herpes Zoster; mientras que es 35 para NPH. En Bélgica, se consideró una estrategia rentable vacunar a los ancianos de 60 años o más.
De Serres et al. estimó que habría que vacunar entre 314,000 y 2,7 millones de personas para prevenir un solo caso de rabia adquirida a través de la exposición a murciélagos. Además, habría que vacunar entre 293 y 2500 proveedores de atención médica para prevenir un caso humano de rabia en el mismo entorno.
El estudio de Hashin también señala la utilidad del NNV en estudios de simulaciones. En lo personal no me gustan estos tipos de diseños por no basarse en la realidad, sino en modelos de estudios matemáticos que no siempre son corroborados, ni siquiera en estudios observacionales. Pero como la idea es mostrar el uso del NNV también incluyo algunos ejemplos:
Dos estudios han utilizado simulaciones de modelos para calcular el NNV para estimar el impacto de los programas de vacunación. Usando un modelo matemático Brisson et al. pudieron calcular el NNV requerido para prevenir los resultados y la muerte asociados con el HPV. Sus hallazgos sugieren que entre las niñas de 12 años, ocho deben vacunarse para prevenir un solo caso de verrugas genitales. Del mismo modo, se tendría que vacunar a 324 niñas para prevenir un solo caso de cáncer de cuello uterino. Es importante mencionar que estos números se calcularon asumiendo que la vacuna contra el HPV brinda protección de por vida con una efectividad de la vacuna del 95 %. En otro estudio, Van Rie y Hethcote aplicaron programas informáticos para calcular el NNV para estimar y comparar la eficacia de cinco estrategias de inmunización diferentes. Descubrieron que el NNV para prevenir un caso de tos ferina era más bajo para la estrategia de adolescentes, mientras que la estrategia capullo tenía el NNV más bajo para prevenir un solo caso en bebés pequeños.
El NNV a menudo se equipara con la métrica del número necesario a tratar (NNT), comúnmente utilizada para evaluar la efectividad de una intervención de atención médica. En términos generales, la NNV se ha utilizado en la literatura para describir tres dominios principales: impacto potencial de un programa de vacunación determinado, análisis económicos y de rentabilidad, y estudios de modelado para comparar diferentes estrategias de vacunación.
Los investigadores que calcularon el NNV para demostrar los beneficios potenciales de determinados programas de vacunación basaron sus cálculos en la diferencia de riesgo u otras fórmulas similares. Los autores intentaron calcular el NNV a través de diferentes puntos finales de salud, comparar diferentes tipos de vacunas, estimar el impacto de la vacunación en poblaciones inmunocomprometidas, evaluar el efecto de vacunaciones repetidas y describir las expectativas del paciente y del médico acerca de la NNV. Como era de esperar, la mayoría de las conclusiones extraídas de este grupo de estudios informaron que los programas de vacunación que requieren un NNV más bajo son más beneficiosos en comparación con los programas que requieren un NNV más alto.
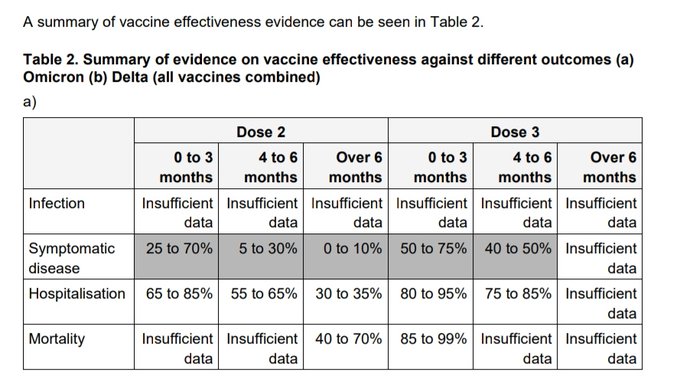
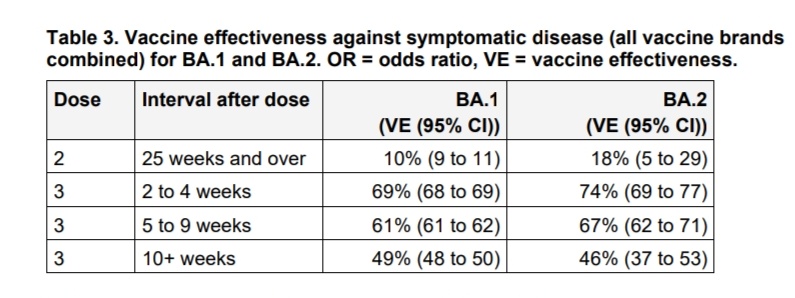
Las estimaciones de NNV variaron ampliamente entre las publicaciones, probablemente relacionadas con el hecho de que son complejas de calcular y dependen de varios factores, incluido el entorno, la población, la prevalencia de la enfermedad y el sistema de atención médica en cuestión. En el caso de Covid-19 se debe incluir la variante y el tiempo desde la vacunación, dado que la efectividad varía principalmente con estos factores. Por lo que a la vista de lo sucedido en los últimos 15 meses debiéramos tener no menos de 5 NNV calculados para cada uno de los efectos a medir. También influyen edad, comorbilidades y estado inmunológico entre otras cosas. Como resultado, las estimaciones de NNV son más relevantes para el grupo de estudio específico para el que se calculan, con una capacidad limitada para una aplicación más amplia. Si bien esto puede ser útil en algunas circunstancias, como el cálculo de la rentabilidad de dos vacunas candidatas para una población específica, esto pone en duda si la NNV es una medida adecuada para su uso tanto en salud pública como en la determinación de beneficios individuales. Pocos reconocen plenamente las limitaciones de NNV, lo que refuerza la necesidad de precaución y más acuerdo sobre cuándo y cómo es apropiado usar este parámetro.
Se cree que NNV es una medida intuitiva de la efectividad de la vacunación comparable a NNT. Sin embargo, esta comparación no ha sido evaluada y puede no ser válida. Cuando se usa el NNT para evaluar medicamentos, los costos y beneficios directos para el individuo son mucho más claros, pueden aplicarse a un período de tiempo más corto y ocurren en estrecha relación temporal con la exposición.
Este no es el caso de NNV, ya que las vacunas son preventivas, los efectos pueden ser indirectos y, a menudo, se desconoce el alcance y el momento exacto o el alcance de la exposición. Kelly et al. argumentan que NNV se considera anualmente porque las enfermedades prevenibles por vacunación tienden a tener un período de incubación corto, un curso corto y pueden reaparecer. Sin embargo, se espera que la mayoría de los programas de vacunación continúen previniendo casos durante varios años, lo que revela otra limitación de la NNV. Además, una vez que las enfermedades se acercan a la eliminación, el NNV se vuelve muy grande e incluso engañoso, ya que la inmunización no puede detenerse en ese punto.
Tuite y Fisman señalaron estas limitaciones en 2013, en un estudio que intentó utilizar el NNV en modelos matemáticos para calcular los efectos indirectos de las vacunas, como la reducción de casos secundarios debido a una menor cantidad de casos transmisibles y los beneficios de la inmunidad colectiva. El estudio criticó el uso de cálculos estándar de NNV y encontró que tienden a producir números sobreestimados en comparación con los cálculos dinámicos de NNV que incorporan los efectos indirectos de los programas de inmunización. El estudio concluyó que los cálculos estándar de NNV subestiman los beneficios potenciales de los programas de vacunación y, por lo tanto, deben usarse e interpretarse con precaución . Los modelos matemáticos dinámicos son herramientas esenciales establecidas para evaluar la necesidad y el impacto potencial de las vacunas, incluidos sus efectos indirectos. Sin embargo, dichos modelos requieren mucho trabajo y son difíciles de entender para los no modeladores. El NNV es una medida más simple, pero es necesario enfatizar sus limitaciones si se usa en forma aislada de enfoques más sofisticados.
En conclusión, NNV se ha utilizado en una amplia variedad de formas en la literatura: para justificar los programas de inmunización, para evaluar los beneficios económicos o de salud pública o para comparar estrategias de inmunización. Su sencillez la convierte en una medida atractiva. Y no hay duda que los estudios citados constituyen más la excepción que la norma habitual para reportar la eficacia en las publicaciones científicas.
Sin embargo, los métodos para calcular el NNV carecen de uniformidad y no hay umbrales definidos para lo que es un NNV favorable, lo que dificulta la interpretación y generalización de esta medida. Además, el NNV no tiene en cuenta los efectos indirectos de la vacunación, por lo que debe utilizarse con precaución. Se requiere más discusión para llegar a un consenso sobre el uso apropiado de NNV en la evaluación de los programas de vacunación.Esto puede verse más acentuado en el caso de las actuales vacunas de Covid-19 donde ya las formas clásicas de reportar la efectividad varian ampliamente según la fecha de aplicación de la última dosis, la variante en cuestión, el tipo de pacientes en las que se aplica (ej. inmunocomprometidos vs inmunocompetentes), según la edad o el tipo de efecto que se quiere medir, sea infecciones, hospitalizaciones o mortalidad.
De esta manera podemos calcular que la incidencia de muertes en Suiza fue durante el mes de enero de 2022, en Suiza de 13 por 100,000 en no vacunados vs. 0.5 en vacunados. Esto es un riesgo de morir 26 veces más en no vacunados, o una efectividad de un 93%, o un NNV de alrededor de 8,000 vacunados para prevenir una muerte**. En tiempos de la variante ómicron y sin calcular el tiempo desde su última dosis. Es decir que números absolutos no faltan, como los críticos de todas las vacunaciones pretenden hacernos creer. No faltan ni en los estudios de seguimientos de efectividad ni faltaron en los ensayos clínicos iniciales. Sabemos que el NNV, como sucedáneo del NNT, es menos claro en tratamientos preventivos, pero se siguen sucediendo los mismos interrogantes que Hashim et al plantearon para los reportes que estudiaron.
Aún así no parece que haga daño reportar los efectos, en los resultados, también en términos absolutos, cuando la enfermedad tiene un rango constante de incidencia, es decir que está en su fase endémica.
También es cierto que, aun si seguimos transmitiendo los valores de efectividad en términos de riesgos relativos, muchas veces nos encontraremos igualmente con decisiones difíciles. Por ejemplo, imaginemos que la efectividad de una vacuna contra una enfermedad cae por debajo del 70% o menos para disminuir la mortalidad. ¿Cuál sería el umbral de efectividad que aceptaríamos? Si se tratara de la única vacuna disponible seguramente seríamos más complacientes. Por lo que siempre, con o sin crisis pandémicas, debemos aspirar a las vacunas más efectivas y seguras que se pueda. En el caso del Covid-19 implica también que resistan nuevas variantes y que la pérdida de efectividad en el tiempo sea menor a la que se observa.
No solo importa como lo medimos, sino también como lo interpretan los individuos y la sociedad. Dar un valor numérico a los resultados es una estrategia de la ciencia para unificar lenguajes, pero la percepción personal puede variar en especial si un número deja de ser una "estadística" para transformarse en una "experiencia vital", por ejemplo en los efectos adversos. Por otro lado siempre es más difícil valorar, a nivel personal, lo que no sucedió: las muertes que no ocurrieron, las internaciones que no sucedieron, etc. Al fin y al cabo la medicina basada en la evidencia también tiene como uno de sus pilares las preferencias personales y sociales.
Referencias
1. Hashim A, Dang V, Bolotin S, Crowcroft NS. How and why researchers use the number needed to vaccinate to inform decision making--a systematic review. Vaccine. 2015 Feb 4;33(6):753-8. doi: 10.1016/j.vaccine.2014.12.033. Epub 2014 Dec 25. PMID: 25543164.
2. Ministerio de Salud Argentina. CONETEC. Umbral de costo-efectividad para las tecnologías sanitarias. Revisión. Enero 2021.
3. Tuite, A. R., & Fisman, D. N. (2013). Number-needed-to-vaccinate
calculations: Fallacies associated with exclusion of transmission. Vaccine, 31(6), 973-978. https://bityl.co/BJ6T [Texto completo]
4. The changing impact of vaccines in the COVID-19 pandemic.
Ioannidis, John P.A., Estimating Conditional Vaccine Effectiveness (Marzo 3, 2022). Disponible en SSRN: https://ssrn.com/abstract=4033819 o http://dx.doi.org/10.2139/ssrn.4033819
*DALY: Disability Adjusted Life Years, o años de vida ajustados por discapacidad.
**NNV = 1/(incidencia entre no vacunados - incidencia entre vacunados)
Imágenes: Alireza Karimi Moghaddan. Caricaturista iraní viviendo en Portugal.