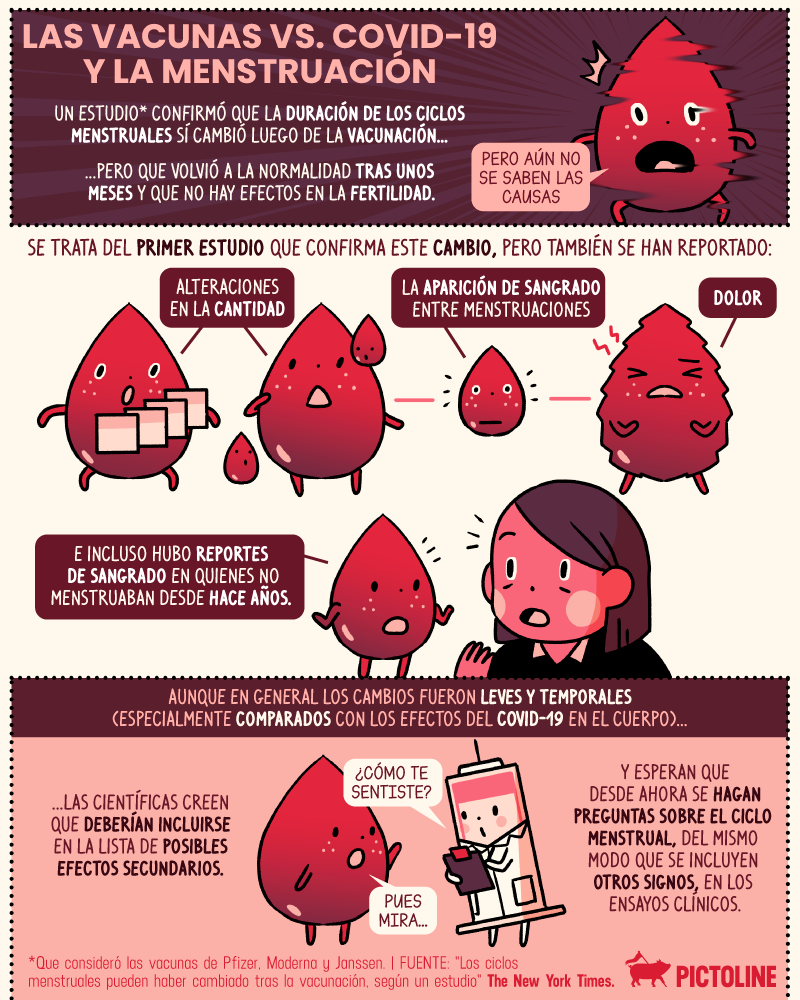
Los estudios clínicos son ensayos para probar la eficacia de
medicamentos, dispositivos y otras formas de tratamiento nuevos, así
como aquellos ya aprobados. Muchos estudios clínicos buscan nuevas
formas de detectar, diagnosticar o medir la extensión de una enfermedad.
Algunos incluso estudian maneras de prevenir el surgimiento de
enfermedades (vacunas). La labor de los investigadores aún se hace mediante
humanos voluntarios para probar estos métodos, aplicando las mismas
reglas. Se destaca que para que la investigación en humanos sea adecuada se deben ajustar a los lineamientos del Código de Nuremberg (vigente desde 1947, tras el fin de la Segunda Guerra).
Los estudios clínicos nos demuestran lo que funciona (y lo que no) en
el campo de la medicina y la atención médica. Estos estudios ofrecen la
mejor forma de aprender sobre lo que funciona en el tratamiento de las
enfermedades. Los estudios clínicos están diseñados para
responder tres cuestiones importantes:
- Eficacia ¿Funciona en personas el nuevo tratamiento propuesto? En caso de que
sí funcione, los médicos determinarán cuán bien lo hace. ¿Es mejor que
los tratamientos que ya se usan actualmente? Si no es mejor, ¿es igual
de eficaz y causa menos efectos secundarios? ¿O funciona en algunas
personas que no responden a los tratamientos actuales?
- Seguridad: ¿Es seguro el nuevo tratamiento? No existe tratamiento o
procedimiento, incluso ninguno de los que se usan normalmente, que no
conlleve un riesgo. Sin embargo, ¿son mayores los beneficios del nuevo
tratamiento que los riesgos?
- Criterio de no inferioridad: ¿Es el tratamiento mejor que el tratamiento convencional que se usa
para la respectiva enfermedad? Los estudios clínicos ayudan a mostrar si
un medicamento o tratamiento nuevo, o si una combinación nueva del
tratamiento, resulta más eficaz que lo usado actualmente.
Estudios preclinicos (o de laboratorio)
Los estudios clínicos se realizan únicamente después de que los
hallazgos en los estudios preclínicos hayan indicado que el tratamiento o
medicamento nuevo podría ser seguro y que funcionará en las personas.
Los estudios preclínicos, también llamados estudios de laboratorio, incluyen:
- Estudios celulares: son a menudo las primeras pruebas que se
realizan para estudiar un nuevo tratamiento. Para determinar si pudiera
ser eficaz, los investigadores analizan los efectos del nuevo
tratamiento sobre células cancerosas que han crecido en una placa de
laboratorio o en un tubo de ensayo. Puede que estos estudios se realicen
en células cancerosas humanas o células cancerosas de animales.
- Estudios en animales: los tratamientos que parecen ser prometedores
en los estudios celulares son después probados sobre, por ejemplo, los cánceres de
animales vivos. Esto proporciona a los investigadores una idea de qué
tan seguro es el nuevo tratamiento en una criatura viviente.
Los estudios preclínicos proporcionan bastante información útil, pero
no todo lo que es necesario saber. Los humanos y los ratones son
diferentes en la forma en como absorben, procesan y desechan los
medicamentos o tratamientos. Un tratamiento que funciona en un ratón puede que no funcione en las personas, y puede que en
las personas surjan efectos secundarios y otros problemas que no se
presentaron cuando el tratamiento se usó en ratones.
Estudios clinicos de fase 0
Aunque los estudios en fase 0 se hacen en humanos, el tipo de estudio
que se hace en esta fase no es como el que se hace en las otras fases
de los estudios clínicos. Los estudios en fase 0 puede que ayuden a los investigadores a
determinar si los medicamentos actúan de la manera que ellos esperaban.
Puede que esto ahorre el tiempo y el dinero en el que se incurrirían en
fases posteriores del estudio.
Los estudios en fase 0 tienen emplean solamente dosis pequeñas de un
medicamento nuevo en pocas personas. Podrían determinar si el
medicamento alcanza el tumor, cómo actúa el medicamento en el cuerpo
humano y cómo responde el organismo. Pudiera ser que las personas en estos estudios requieran
someterse a pruebas adicionales, tales como biopsias, estudios por imágenes y análisis de sangre adicionales como parte de los procedimientos.
A diferencia de otras fases de los estudios clínicos, casi no hay
probabilidad de que en la fase 0 las personas notarán algún beneficio.
El beneficio se verá en otras personas más adelante. Y debido a que las
dosis del medicamento son bajas, también el riesgo será menor entre los
participantes.
Los estudios en fase 0 no se usan ampliamente, y hay algunos
medicamentos para los cuales estos estudios no serían útiles. Los
estudios en fase 0 son muy pequeños, a menudo con menos de 15 personas, y
el medicamento se administra solamente por un tiempo breve. No
conforman una parte requerida para probar un medicamento nuevo.
Estudios de fase ILos estudios en fase I para un medicamento nuevo por lo general son
el punto en los que por primera vez se involucra a personas. Los
estudios en fase I son para determinar la dosis mayor que pueda darse de
forma segura de un nuevo tratamiento sin causar efectos secundarios
graves. Aunque el tratamiento se ha probado en el laboratorio y en
estudios en animales, no siempre es posible predecir los efectos
secundarios en las personas. Estos estudios también son útiles para
decidir la mejor forma de administrar un nuevo tratamiento.
- El primer grupo pequeño de personas en el estudio recibe una dosis
baja del tratamiento y es observada minuciosamente. Si solo surgen
efectos secundarios menores, el próximo grupo pequeño de participantes
recibe una dosis más alta. Este proceso continúa hasta que los médicos
encuentran la dosis más propensa a funcionar mientras se mantiene un
nivel aceptable de efectos secundarios.
- Los estudios en fase I también determinan el efecto que el medicamento tiene sobre el cuerpo.
- La seguridad es la principal prioridad. El equipo de investigación
realiza un seguimiento minucioso con los participantes y están al
pendiente de cualquier efecto secundario grave. Debido al pequeño número
de personas en los estudios en fase I, puede que los efectos
secundarios que sean poco comunes no sean observados sino hasta después
con más participantes.
- Mientras puede que algunas personas se beneficien de participar en
el estudio, la respuesta que el la enfermedad tiene ante el tratamiento
no es el objetivo de la fase 1.
- Los placebos (tratamientos inactivos) no forman parte en la fase 1 del estudio.
- En los estudios de fase 1 incluye un número reducido de participantes (hasta una docena por lo general).
- Los estudios de fase 1 la mayoría de las veces incluye a personas con distintos tipos de cáncer.
- Estos estudios se llevan a cabo generalmente en centros importantes de atención de pacientes con cáncer.
Los estudios en fase 1 conllevan un potencial mayor de riesgo. aunque
sí ha habido algunos pacientes que han llegado a beneficiarse. Para
aquellas personas que tienen enfermedades que ponen la vida en peligro,
es crucial sopesar los riesgos y los beneficios potenciales
cuidadosamente. En ocasiones las personas optan por participar en la
fase 1 de los estudios cuando todas las demás opciones actuales de
tratamiento ya fueron probadas.
Estudios de fase II
Si en la fase 1 se determina que un tratamiento nuevo es seguro,
entonces se procede con la fase 2 para determinar su eficacia. El beneficio que los médicos buscan depende de
la meta del tratamiento. Esto puede que implique evidencia de que los sintomas o signos desaparezcan, que los mismos no hayan aumentado, o que se encuentre mejoria en la calidad de vida. Raramente encontramos estudios que evaluen una disminución de la mortalidad.
- Un grupo entre 25 y 100 personas con igual enfermedad recibe
el nuevo tratamiento. Se administra el
tratamiento de acuerdo con la dosis y el método que se determinaron ser
los más seguros y efectivos en la fase I del estudio.
- Por lo general, en la fase II de los estudios todos reciben la misma
dosis. No obstante, algunos estudios en fase II se asignan a personas
de manera aleatoria a grupos con distintos tratamientos. En estos grupos
puede que se administren distintas dosis o que el tratamiento se
administre en distintas maneras para ver cuál ofrece el mejor balance de
seguridad y eficacia.
- Los placebos (tratamientos inactivos) no forman parte de los estudios clínicos en fase II.
En los estudios clínicos en fase II, grandes cantidades de pacientes
reciben el tratamiento, pudiendo reducir el número de efectos
secundarios que ocurren de manera común (es decir, la diversidad pudiera
aumentar). Si suficientes pacientes se benefician del tratamiento y los
efectos secundarios no fueron muy nocivos, entonces se procede con la
fase III del estudio clínicos.
Estudios en fase III
Los tratamientos que han demostrado que funcionan en estudios
clínicos de fase II por lo general tienen que superar exitosamente otra
fase antes de que sean aprobados para su uso general. Los estudios
clínicos en fase III comparan la seguridad y eficacia del nuevo
tratamiento con el tratamiento estándar actual, de modo de asegurar que se cumple con el criterio de no inferioridad, es decir que el nuevo tratamiento es mejor o igual que el tratamiento existente. Cuando no existe ningún tratamiento farmacologico existente se suele utilizar placebo, aunque en la mayoria de los casos, aún con tratamiento existente se suele utilizar placebo y raramente se comparan contra un medicamento de su misma clase farmacologica (ej. enalapril vs rampril, o cualquier otro inhibidor de la enzima convertidora).
Debido a que los médicos aún no conocen cuál tratamiento es mejor, a
menudo los participantes del estudio que van a recibir el tratamiento
estándar y los que van a recibir el tratamiento nuevo se escogen al azar
(asignación aleatoria). Cuando sea posible, tanto el
doctor como el paciente desconocen cuál tratamiento es el que está
recibiendo el paciente. Este tipo de estudio puede ser doble ciego, si el médico y el paciente no saben que se le ha administrado. La realización aleatoria y la ocultación de los procedimientos se detallan posteriormente.
- La mayoría de los estudios clínicos en fase III incluyen un gran número de participantes, al menos varios cientos.
- Por lo general estos estudios se llevan a cabo en varios lugares a un mismo tiempo.
- Estos estudios suelen tomar más tiempo que los estudios en las fases I y II.
- Puede que se incluyan placebos en los estudios en fase III, pero
nunca se usan solos si hay disponible un tratamiento que funciona. En
ocasiones, una persona que haya aleatoriamente sido asignada para
recibir un placebo como participante de un estudio en algún punto
también recibirá el tratamiento convencional. Por ello es importante que el análisis estadistico se haya realizado por intención de tratar.
Al igual que con las otras fases de los estudios clínicos, los
pacientes son examinados minuciosamente para identificar efectos
secundarios y en caso de que sean muy problemáticos de controlar, se
procede con descontinuar la realización del estudio.
Ensayos de Fase IV
También conocidos como de post-comercialización. El tratamiento ya está siendo comercializado, y se evalua la efectividad en el mundo real del mismo. Estos estudios también son conocidos como Real World Evidence. Estos estudios suelen ser observacionales, y evaluan como funciona el nuevo tratamiento en circunstancias reales, y no controladas como en la fase III. Estos estudios suelen tomar una mayor cantidad de persona. Permite también ajustar los efectos adversos a los que se habian observado en las fases anteriores, y evaluar mejor su incidencia frente a los reportes de farmacovigilancia. Ejemplo de esto pueden ser los estudios de cohorte que miden si una población vacunada se ha enfermado, internado o muerto menos que el control. Donde el control serán los no vacunados de la misma población:

En los estudios de efectividad, las variables que aparecian controladas en un estudio de fase 3, aqui no lo están. En este caso particular, era relevante conocer cual era la efectividad en el mundo real, ya que en los estudios de eficacia esta vacuna habia tenido un rendimiento que oscilaba entre el 51% y el 83%, en dos estudios diferentes que se habian realizado en Brasil y Turquia, respectivamente. Con el tamaño de la población estudiada en Chile, dificilmente los investigadores puedan haberse equivocado. Toda variación de estos resultados solo es posible si el estudio se realizara en un contexto diferente. Por ejemplo con la presencia de otra variante del virus, o bien al año de haberse vacunado, o en un subgrupo especifico, como mayores de 70 años o en inmunosuprimidos.
Otro ejemplo podria ser una droga antihipertensiva que se sabe que disminuye la tensión arterial, pero en la práctica no demuestra disminuir la mortalidad o los eventos mayores cardiovasculares (MACE o Major Cardiovascular Events).
O bien un medicamento de alta eficacia que muestra un efecto adverso de tal frecuencia o gravedad que anula los beneficios obtenidos, ejemplo de esto último es el rofecoxib, un analgésico no AINE, que fue retirado del mercado por su fabricante en 2004 ante la evidencia de que aumentaba el riesgo cardiovascular, y que dió lugar a juicios millonarios en algunos paises. En este caso la evidencia no solo provenia de informes de farmacovigilancia, sino también de al menos un metanálisis publicado.
Diccionario de ensayos clínicos (en inglés).