La tos ferina es endémica en todo el mundo, con picos epidémicos cada 2 a 5 años, y es muy contagiosa. Hasta el 90 % de los contactos en el hogar y entre el 50 % y el 80 % de los contactos en un aula se infectarán después de la exposición.
¿Por qué la tos ferina es importante?
Bebés y niños: La tos ferina afecta a todas las edades, pero con mayor gravedad a los lactantes, que experimentan la mayor incidencia específica por edad y representan casi todas las hospitalizaciones y muertes por tos ferina. Incluso ahora, más del 80 % de los lactantes de Estados Unidos menores de 2 meses con casos notificados de tos ferina son hospitalizados.
La tos ferina generalmente comienza como una infección leve de las vías respiratorias superiores. Una tos ocasional progresa en 1 o 2 semanas para convertirse en paroxística, aumentando en frecuencia y gravedad antes de desaparecer gradualmente en un período de varias semanas o más. Los paroxismos se caracterizan por una serie de toses rápidas sin respirar, seguidas del grito característico, un esfuerzo desesperado por respirar a través de una glotis hinchada. Durante un paroxismo, el paciente puede volverse cianótico y el vómito puede seguir al paroxismo. Varios paroxismos pueden ocurrir sucesivamente en unos pocos minutos, dejando al paciente exhausto. Los paroxismos pueden ser inducidos por estímulos como comer, reír o llorar y suelen empeorar por la noche. Entre paroxismos, el paciente parece normal. La tos ferina generalmente no se asocia con fiebre, pero sí con linfocitosis, especialmente entre los bebés y los niños pequeños. A medida que la enfermedad se resuelve, la tos no paroxística puede persistir durante muchas semanas y las infecciones virales intercurrentes pueden desencadenar una recurrencia de los paroxismos.
Un gran estudio sobre la tos ferina en bebés y niños en Alemania, antes de la vacunación universal contra la tos ferina, encontró que el 90 % de los pacientes no vacunados con tos ferina comprobada tenían tos paroxística, el 79 % estridor, el 53 % experimentaron vómitos posteriores a la tos, pero solo el 6 % tenían fiebre .
La temible reputación de la tos ferina no se basa simplemente en que sea generalizada, prolongada y muy desagradable; puede traer incapacidad permanente o muerte. En el estudio alemán, la tasa global de complicaciones graves en lactantes y niños fue del 6 %, y del 24 % entre los lactantes menores de 6 meses. Estas complicaciones se dividen en 3 grupos principales: pulmonares, neurológicas y nutricionales. Las más frecuentes son las complicaciones pulmonares que incluyen neumonía tanto intersticial como alveolar y, en casos graves, insuficiencia respiratoria. Los hallazgos de la autopsia muestran pulmones llenos de células inflamatorias, edema fibrinoso y abundantes bacterias de la tos ferina. Puede producirse hipertensión pulmonar; los lactantes menores de 6 semanas de edad con hipertensión pulmonar tienen la mayor mortalidad.
También se informan complicaciones neurológicas de la tos ferina. Los paroxismos de tos y la hipoxia asociada pueden provocar encefalopatía aguda y/o hemorragia intracraneal. Un estudio en Dinamarca encontró que la hospitalización por tos ferina se asoció con un riesgo aproximadamente dos veces mayor de epilepsia a la edad de 10 años. El CDC informó que la encefalopatía ocurre en el 0,4% de los bebés hospitalizados con tos ferina. Aproximadamente un tercio de los niños con encefalopatía por tos ferina mueren durante la enfermedad aguda y otro tercio sobrevive con daño cerebral permanente. Las causas de la encefalopatía relacionada con la tos ferina no están claras; las posibilidades incluyen anoxia debida a tos paroxística, hipoglucemia, alteraciones metabólicas, hemorragias intracraneales puntuales o un efecto tóxico directo.
Las deficiencias nutricionales también pueden surgir durante la enfermedad de la tos ferina, debido a la dificultad de alimentación ante los paroxismos de tos y las consecuencias de los vómitos pos tusígenos. Otras complicaciones incluyen hemorragias subconjuntivales y epistaxis debido a los paroxismos, edema de la cara y úlceras debajo de la lengua. Las infecciones del oído medio también son comunes y se deben a los patógenos habituales asociados con la otitis.
Adolescentes y adultos: un gran estudio canadiense encontró que los adolescentes y adultos con tos ferina confirmada tenían una mediana de 8 semanas de tos, incluidas 6 semanas con tos violenta; El 46% informó vómitos, el 84% informó tos nocturna y el 14% informó apnea que duró 30 segundos después de la tos. Los adultos tenían mayores tasas de complicaciones que los adolescentes. Un estudio alemán de 79 adultos con tos ferina sintomática encontró que el 80 % tenía tos de más de 3 semanas, el 63 % tenía tos paroxística prolongada, el 52 % se mantenía despierto por la tos, el 42 % vomitaba después de toser, pero solo el 8 % tenía estridor; 1 persona tosió durante 8 meses. El 14% informó ataques de sofocos y sudoración que duraron de 1 a 2 minutos, ocurrieron varias veces al día y continuaron durante 2 a 8 semanas. Las complicaciones fueron reportadas por 23% e incluyeron otitis media, neumonía, incontinencia urinaria, fractura de costillas y pérdida severa de peso. En un estudio de Massachusetts de 314 adolescentes y 203 adultos con tos ferina confirmada, los pacientes informaron tos paroxística (74 % y 84 %, respectivamente), problemas para dormir (77 % y 84 %), vómitos (56 % y 54 %), incontinencia urinaria ( 3% y 28%), pérdida de peso (33% y 33%), fractura de costilla (1% y 4%) y pérdida de conciencia (1% y 6%). Otras complicaciones conocidas de la tos ferina en adultos incluyen el desencadenamiento de migrañas, disección de la arteria carótida, desmayo después de toser y pérdida de memoria. La muerte es rara en adolescentes y adultos, pero ocurre.
Epidemiología: Antes de la vacunación generalizada contra la tos ferina, los Estados Unidos registraban anualmente hasta 270,000 casos de tos ferina con hasta 10,000 muertes. Sin embargo, estos solo representaron los casos que fueron reportados; se cree que casi todos los niños contrajeron tos ferina. La introducción de la vacuna contra la tos ferina condujo a una disminución dramática en la tos ferina reportada.
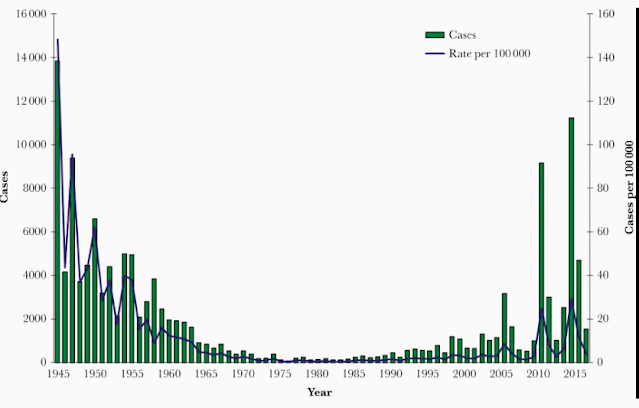
Aunque alguna vez se creyó que la enfermedad de la tos ferina producía protección de por vida, la inmunidad después de la infección disminuye y pueden ocurrir episodios repetidos de la enfermedad. Antes de la vacunación generalizada, la tos ferina era tan común entre los niños que una enfermedad leve o inaparente reforzaba repetidamente la inmunidad de los adolescentes y adultos. La reducción de la tos ferina pediátrica mediante la vacunación significó que la inmunidad entre las personas mayores ya no estaba siendo reforzada naturalmente por las exposiciones comunitarias y los recuentos de casos comenzaron a aumentar. Durante la década de 1990, numerosos estudios en América del Norte, Europa y Australia demostraron que la tos ferina se presentaba comúnmente en adultos. A fines de la década de 1990 y principios de la de 2000, las tasas de tos ferina en adolescentes y adultos aumentaron considerablemente. En los Estados Unidos, las tasas entre 2000 y 2003 fueron de 5 veces más altas para los adolescentes y adultos en comparación con 1990 y 1993. Las tasas de tos ferina en adolescentes y adultos continuaron aumentando hasta que se adoptaron estrategias de vacunación de refuerzo. Como se analiza a continuación, la vacunación materna está reduciendo la tos ferina entre la población de mayor riesgo, los bebés pequeños. Sin embargo, como ilustra la Figura 1 , los recuentos de casos de tos ferina continúan aumentando, salpicados por brotes de una magnitud no vista desde la década de 1940. Las características inmunológicas de las vacunas acelulares actuales contribuyen a este problema (que se analiza más adelante), al igual que la presencia continua —de hecho, en muchos lugares, el crecimiento— de poblaciones subvacunadas o no vacunadas.
Número e incidencia de casos de tos ferina notificados por año de inicio: California, 1945–2016 (incluye casos notificados hasta el 23 de enero de 2017)
Desde 1980, el recuento mundial de casos de tos ferina ha disminuido más del 90% a medida que ha aumentado la cobertura de inmunización. Sin embargo, la evaluación se complica por el hecho de que los datos de vigilancia de la tos ferina tienden a ser limitados o inexistentes en los países de ingresos bajos y medianos. Además, especialmente en África, todavía persisten marcadas variaciones en la cobertura de la vacuna contra la tos ferina entre y dentro de las naciones, con grandes áreas de cobertura por debajo del 50%. Una encuesta serológica realizada entre 2013 y 2016 en 7 países asiáticos encontró evidencia de una sustancial circulación de B. pertussis, con 1 de cada 20 sujetos con evidencia serológica de infección reciente. Una revisión de la tos ferina en los 7 países representados en la Asociación de Naciones del Sudeste Asiático encontró una variación sustancial en los calendarios de vacunación y las tasas de tos ferina, y la verdadera carga de la enfermedad sigue sin estar clara debido a la falta de datos confiables. Otro factor que causa una variabilidad considerable en la epidemiología de la tos ferina en países pobres es el hecho de que las vacunas que incorporan componentes de tos ferina acelular (aP) están disponibles en el mercado privado en la mayoría de los países que usan vacunas de tos ferina de células enteras (wP) en sus programas públicos de vacunación, con una penetración en el mercado de cada una que varía sustancialmente de un país a otro.
Bacteriología y patología: Bordetella pertussis es un bacilo gramnegativo pequeño, pleomórfico. El organismo contiene numerosos antígenos, incluida la toxina pertussis (PT), la hemaglutinina filamentosa (FHA), la pertactina (PRN), varios serotipos de aglutinógenos fimbriales, la toxina adenilato ciclasa, la citotoxina traqueal, la toxina termolábil, la resistencia de Bordetella a la proteína letal (BrkA), y endotoxina ( Tabla 1 ).
Desde 2007, estudios en muchos países han identificado una prevalencia creciente de cepas de B. pertussis circulantes deficientes en 1 o más antígenos incluidos en las vacunas aP. Esto ha suscitado la preocupación de que la eficacia de las vacunas aP podría reducirse, pero no se ha encontrado evidencia de ello.
La Bordetella pertussis se adhiere fuertemente a las células epiteliales respiratorias ciliadas; proteínas de unión importantes incluyen PT, FHA, proteínas fimbriales, PRN y BrkA. El organismo generalmente no invade las células submucosas o el torrente sanguíneo, pero sus toxinas pueden producir efectos sistémicos. Las proteínas y toxinas de B. pertussis le permiten interferir ampliamente con el sistema inmunológico, incluida la inhibición del complemento, los fagocitos y las respuestas de células T y B.
Transmisión, transporte, diagnóstico y tratamiento
La tos ferina generalmente se transmite a través de grandes gotitas respiratorias generadas al toser o estornudar. Sin embargo, el modelo de infección por B. pertussis en babuinos ha demostrado transmisión por aerosoles y se ha observado transmisión silenciosa en humanos. El advenimiento de los ensayos sensibles de reacción en cadena de la polimerasa (PCR) ha demostrado que las muestras nasofaríngeas de personas vacunadas asintomáticas expuestas a casos de tos ferina a menudo son PCR positivas, y que existe una alta prevalencia de infección asintomática entre las personas expuestas en el hogar.
El cultivo ha sido tradicionalmente el estándar de oro para el diagnóstico de la tos ferina, pero tiene limitaciones sustanciales. El organismo es fastidioso y requiere técnicas especiales de transporte y cultivo. Además, la capacidad de recuperar organismos en cultivo se desvanece al principio de la enfermedad, a menudo antes de que se sospeche la tos ferina. Por el contrario, la PCR puede permitir la detección varias semanas después de la enfermedad y se pueden detectar organismos no viables. La serología todavía se usa comúnmente, particularmente en ensayos clínicos y con fines epidemiológicos. El diagnóstico serológico es más confiable cuando se basa en un aumento significativo de anticuerpos de muestras agudas a convalecientes, pero a menudo solo se dispone de una muestra convaleciente, en cuyo caso el resultado se puede comparar con un umbral pre especificado.
La administración de macrólidos al principio de la enfermedad reduce la duración y la gravedad de la enfermedad y disminuye la infectividad. La profilaxis posterior a la exposición reduce el riesgo de tos ferina al erradicar B. pertussis de la nasofaringe. Las cepas resistentes a los macrólidos se han vuelto cada vez más frecuentes en China y han aparecido ocasionalmente en otros lugares. Aunque la mayoría de las personas que no reciben tratamiento eliminan la B. pertussis espontáneamente en 3 a 4 semanas después del inicio de la tos, el organismo puede persistir durante 6 semanas o más. Los casos y los contactos inadecuadamente vacunados deben excluirse de la escuela, la guardería y entornos similares hasta que hayan recibido al menos 5 días de tratamiento.
Vacunas antipertusis de células enteras
A fines de la década de 1940, las vacunas contra la tos ferina elaboradas a partir de suspensiones de organismos muertos (llamadas vacunas de células completas) habían demostrado su eficacia en ensayos clínicos y estaban disponibles en combinación con toxoides diftérico y tetánico (DTP). Estas vacunas DTP se usaron de forma rutinaria en los Estados Unidos y en muchos otros países, lo que llevó a una disminución drástica de la morbilidad y mortalidad de la tos ferina. Estas vacunas actualmente siguen en uso en la mayoría de los países con bajos o medianos ingresos.
Beneficios
La eficacia de las vacunas wP se ha demostrado repetidamente, comenzando con estudios en las Islas Feroe en 1923 y 1929 y en Michigan a principios de la década de 1930. Durante los estudios de las vacunas contra la difteria, el tétanos y la aP (DTaP) realizados en la década de 1980 en Alemania, Inglaterra, Suecia, Italia y Senegal, se evaluaron las vacunas y su eficacia contra la enfermedad sintomática y osciló entre el 83 % y el 98 % para 4 de las vacunas. Una vacuna estadounidense fue sustancialmente menos eficaz (36 % a 48 %).
Japón introdujo la vacuna contra la tos ferina en 1949 y los casos notificados de tos ferina y las muertes disminuyeron notablemente. Sin embargo, en 1975, las preocupaciones ampliamente difundidas acerca de los eventos adversos que supuestamente se debían a la vacuna DTP llevaron al cese de la vacunación contra la tos ferina en bebés y niños pequeños. La tos ferina epidémica reapareció; los casos aumentaron de 206 en 1971 a más de 13,000 en 1979, con cientos de muertes infantiles. Se observó un patrón similar en Inglaterra y Gales, donde las tasas de aceptación de la vacuna contra la tos ferina cayeron al 25% a mediados de la década de 1970. Regresaron grandes epidemias de tos ferina, con numerosas muertes. En 1979, Suecia suspendió el uso de una vacuna DTP que se consideró poco eficaz; la incidencia de tos ferina se cuadruplicó con creces a partir de entonces, con varios brotes importantes. En cada país, después de la eventual reanudación de la vacunación contra la tos ferina (utilizando vacuna de células enteras en el Reino Unido, vacuna acelular en Japón y Suecia), las tasas de tos ferina volvieron a disminuir.
El beneficio de la vacunación contra la tos ferina no se mide únicamente por la enfermedad evitada sino también por la disminución de la gravedad de la enfermedad. Particularmente durante los brotes, la presión de la infección es lo suficientemente alta como para que las personas debidamente vacunadas puedan, no obstante, contraer la enfermedad de la tos ferina. Múltiples estudios han demostrado que tales casos de avance son sustancialmente más leves que los casos en personas no vacunadas o con vacunación insuficiente.
Eventos adversos con vacunas de céulas enteras
Las vacunas contra la tos ferina de células enteras se encuentran entre las más reactógenas de las vacunas administradas de forma rutinaria. Se producen reacciones menores locales (enrojecimiento, hinchazón y dolor en el lugar de la inyección) y sistémicas (fiebre, irritabilidad y somnolencia) en aproximadamente la mitad de los receptores de DTP, 5 veces más que la tasa observada con la vacuna contra la difteria y el tétanos (DT) . Se informa que el llanto agudo inusual o el llanto inconsolable persistente que comienza de 2 a 8 horas después de la vacunación y dura 1 hora o más ocurre en el 3% al 4% de los niños. Los toxoides diftérico y tetánico también se asocian, con poca frecuencia, con convulsiones febriles y episodios hipotónicos-hiporreactivos (HHE), estados similares a un shock que comienzan dentro de las 12 horas posteriores a la vacunación, duran varias horas y se resuelven sin secuelas. Las convulsiones febriles y HHE ocurren en aproximadamente el 0,06% de los niños vacunados.
La reacción más grave que se atribuyó a la DTP fue la encefalopatía aguda. La identificación del síndrome de Dravet, una encefalopatía epiléptica debida a una mutación del canal de sodio, ha ampliado la comprensión de la encefalopatía después de la vacunación. Se cree que la fiebre asociada con la vacuna DTP probablemente desenmascara el síndrome y las consiguientes convulsiones en estos niños, en lugar de que la vacuna misma causara encefalopatía.
Las preocupaciones con respecto a la DTP crecieron a principios de la década de 1970, particularmente en países donde la vacunación generalizada había eliminado la mayoría de las enfermedades y los padres jóvenes y los médicos nunca habían sido testigos de la morbilidad y mortalidad de la tos ferina. Si bien las leyes de inmunización para el ingreso a la escuela permitieron que se mantuvieran las tasas de vacunación en los Estados Unidos, los litigios que alegaban daños causados por las vacunas contribuyeron a que la mayoría de los fabricantes de los Estados Unidos suspendieran la producción de la vacuna contra la tos ferina. Esto llevó al Congreso de los EE. UU. a aprobar la Ley Nacional de Lesiones por Vacunas Infantiles, que limita las demandas civiles al tiempo que proporciona una compensación rápida y segura por los eventos adversos reconocidos como relacionados con las vacunas.
A principios de la década de 1990, el Instituto de Medicina revisó cuidadosamente la evidencia de una relación causal entre las vacunas y varios eventos adversos. La conclusión fue que no existía una relación causal entre la vacunación con DTP y el síndrome de muerte súbita del lactante, convulsiones afebriles, espasmos infantiles o síndrome de Reye. Por el contrario, se consideró que la evidencia indicaba que la DTP era una causa de anafilaxia, llanto prolongado o inconsolable y convulsiones febriles y era consistente con la causa de la encefalopatía aguda y HHE.
Vacunas pediátricas contra la tos ferina acelular
Los esfuerzos para desarrollar vacunas contra la tos ferina menos reactogénicas comenzaron en Japón después de que cesó la vacunación DTP a mediados de la década de 1970. Las vacunas aP iniciales estaban compuestas predominantemente de FHA junto con cantidades más pequeñas de PT inactivado y, a menudo, trazas de proteínas fimbriales y PRN. Pronto siguieron otras vacunas aP que contenían cantidades iguales de PT y FHA. Las vacunas acelulares contra la tos ferina se han utilizado exclusivamente en Japón desde 1981; los estudios de contacto en el hogar y la vigilancia de la tos ferina después de la implementación de las vacunas acelulares demostraron su eficacia.
Durante la década de 1980, se desarrollaron unas 2 docenas de vacunas acelulares en varios países y demostraron tasas y severidades mucho más bajas de reacciones adversas. Las vacunas contra la difteria, el tétanos y la aP han reemplazado por completo a la DTP en los Estados Unidos, Canadá, Australia, la mayor parte de Europa y en algunos países de Asia y América Latina, y están disponibles en los mercados privados de casi todos los países.
Ensayos multicéntrico de tos ferina acelular: A principios de la década de 1990, el ensayo multicéntrico de tos ferina acelular (MAPT) patrocinado por el National Health Institute de Estados Unidos, evaluó 13 vacunas acelulares y 2 de células completas para determinar cuál era la más prometedora para su inclusión en la posterior eficacia a gran escala. ensayos. Las vacunas DTaP diferían con respecto al número de proteínas de B. pertussis incluidas , la cantidad de cada proteína incluida, los métodos de fabricación y desintoxicación de las proteínas y la elección de adyuvantes y excipientes. Las respuestas de anticuerpos difirieron sustancialmente entre las vacunas acelulares, pero cada vacuna estimuló respuestas de anticuerpos significativas a sus antígenos incluidos, en la mayoría de los casos igualando o superando la respuesta de anticuerpos producida por la vacuna de células completas de referencia.
Ensayos de eficacia: Entre 1985 y 1993, se realizaron 9 grandes estudios de vacunas aP en Europa o África en áreas que no vacunan contra la tos ferina de forma rutinaria. Los protocolos de los ensayos y las vacunas incluidas diferían sustancialmente. No obstante, a pesar de sus limitaciones y antigüedad, estos estudios se mantienen entre las mejores fuentes de información sobre las vacunas evaluadas. Es improbable que se realicen nuevos ensayos de eficacia contra la tos ferina; las vacunas contra la tos ferina se recomiendan en todo el mundo, lo que hace imposible un grupo de placebo, y las vacunas actuales son tan eficaces en los primeros años de vida que el tamaño de la muestra de un ensayo comparativo sería prohibitivo.
Un estudio realizado en 1986 en Estocolmo comparó 2 vacunas japonesas, una que contenía tanto PT como FHA y la otra solo PT, pero en mayor cantidad. Los resultados iniciales de eficacia fueron decepcionantes con un 69 % y un 54 %, respectivamente, pero análisis posteriores que utilizaron una definición de caso de enfermedad confirmada por cultivo con al menos 21 días de tos espasmódica (una definición adoptada por la OMS y utilizada en estudios posteriores ensayos de eficacia) encontraron eficacias del 81% y 75%, respectivamente. La vacuna que contenía más PT fue más eficaz para prevenir las manifestaciones graves de la tos ferina, mientras que la vacuna que contenía tanto PT como la proteína de unión FHA fue más eficaz para prevenir la enfermedad leve o moderada.
A principios de la década de 1990, se evaluaron varias vacunas DTaP candidatas en 8 ensayos de eficacia, de los cuales 4 fueron patrocinados por los NIH y 4 por los fabricantes de la DTaP evaluada. Todos los estudios patrocinados por el NIH fueron prospectivos, doble ciego, aleatorizados y contenían un brazo de control de células completas, un grupo de placebo o ambos. Un estudio realizado en Göteborg, Suecia (1991–1994) vacunó a niños a los 3, 5 y 12 meses (el programa sueco estándar) con Certiva, una vacuna DTaP que contiene 40 mcg de PT desintoxicada con peróxido; no se incluyó ninguna vacuna de comparación. Según la definición de caso de la OMS, la eficacia de Certiva fue del 71 %. Un estudio realizado en Italia (1992–1993) comparó un DTP estadounidense de Connaught con Infanrix y Acelluvax, cada uno de los cuales contenía PT. Las vacunas acelulares tuvieron una eficacia del 84 %, mientras que la eficacia de la vacuna de células enteras de Connaught fue solo del 36 % . Un estudio complementario en Estocolmo (1992–1993) evaluó Tripacel y un DTaP de 2 componentes (nunca autorizado) usando el mismo programa y control de DTP; las eficacias fueron del 85 % para Tripacel y del 48 % para el DTP. Un segundo estudio en Estocolmo (1993–1996) evaluó la formulación de mayor potencia de Tripacel utilizada en vacunas combinadas posteriores contra Acelluvax, utilizando una DTP británica (Medeva-Wellcome) como control. El riesgo relativo de tos ferina definido por la OMS fue un 38 % más bajo para Tripacel de mayor potencia en comparación con Acelluvax (debido a que no hubo un grupo de placebo, no se puede calcular la eficacia absoluta).
De los 4 ensayos de eficacia patrocinados por el fabricante, solo 1 evaluó una vacuna que sigue estando disponible a nivel mundial. Un estudio en Senegal (1990–1994) comparó Triavax con la vacuna DTP fabricada en Francia de esa compañía. Las estimaciones de la eficacia absoluta en este estudio aleatorizado y doble ciego se derivaron de un estudio anidado de casos y contactos que comparó las tasas de tos ferina después de la exposición a un caso índice entre los sujetos del estudio vacunados a los 2, 4 y 6 meses de edad y los niños que no estaban en el estudio ( que recibieron DT o ninguna vacuna) que viven en los mismos conjuntos habitacionales. Las estimaciones de eficacia absoluta fueron del 74 % (intervalo de confianza [IC] del 95 %, 51 %–86 %) para Triavax y del 92 % (IC del 95 %, 81 %–97 %) para DTwP; los límites de confianza son amplios porque el número total de casos fue pequeño, particularmente en el grupo que no había recibido la vacuna contra la tos ferina. Se realizaron ensayos de eficacia adicionales patrocinados por el fabricante en (1) Munich, 1993–1995, (2) Erlangen, Alemania, 1991–1994 [177] y (3) Mainz, Alemania, de 1992–1994.
Conclusiones de los ensayos de eficacia y estudios de seguimiento
Las vacunas aP estudiadas se asociaron con índices notablemente más bajos de eventos adversos en comparación con la vacuna de células enteras, al tiempo que proporcionaron una eficacia que se acercó o superó a la de la vacuna de células enteras. Aunque las vacunas diferían en eficacia, los datos de vigilancia nacional han demostrado que cada vacuna acelular adoptada para uso rutinario ha brindado un excelente control de la tos ferina durante las edades cubiertas por la serie de vacunación infantil. La primera dosis de la vacuna aP brinda una protección modesta pero importante; la segunda dosis proporciona una protección sustancialmente mayor. La mejor protección se logra con 3 dosis primarias (ya sea a los 2, 4 y 6 meses; 3, 5 y 7 meses; o incluso a los 2, 3 y 4 meses) con un refuerzo en el segundo año de vida. El cronograma escandinavo (3, 5 y 12 meses) da una leve menor protección entre la segunda y tercer dosis, pero mejor protección después, comparado con otros esquemas de 3 dosis.
Eventos adversos con vacunas acelulares pediátricas
Se han realizado muchos estudios en lactantes y niños que comparan vacunas acelulares con vacunas de células completas y han encontrado invariablemente que las vacunas acelulares se asocian con tasas más bajas de reacciones adversas que las vacunas de células completas. La Tabla 2 muestra las tasas de reacciones adversas solicitadas observadas en el MAPT y los ensayos de eficacia seleccionados para las 3 vacunas aP que permanecen comercialmente disponibles en 2020, sus vacunas de control de células completas y la única vacuna DTaP evaluada que contiene un componente PT inactivado genéticamente.
Seguridad de la dosis de refuerzo
Los estudios de seguimiento del MAPT evaluaron la cuarta y la quinta dosis de la vacuna acelular administrada entre los 15 y los 20 meses y entre los 4 y los 6 años, respectivamente. El enrojecimiento, la hinchazón, el dolor y la fiebre en el lugar de la inyección se observaron con mayor frecuencia con la cuarta dosis consecutiva de la vacuna acelular que con la serie primaria, pero aún a tasas más bajas que las observadas en los niños que recibieron 4 dosis consecutivas de la vacuna de células completas. Se observaron varios casos de hinchazón de toda la extremidad después de la administración de la cuarta dosis de vacuna acelular. De 1015 niños que recibieron 4 dosis sucesivas de vacuna aP, 20 (2 %) informaron inflamación de todo el muslo después de la cuarta dosis frente a ninguno de los 246 niños vacunados con células enteras y reforzados con vacuna acelular. Entre los niños que recibieron 5 dosis sucesivas de vacuna acelular, la hinchazón comenzó el día 1 o 2 después de la vacunación y generalmente se resolvió el día 4, sin secuelas. La aparición de hinchazón en toda la extremidad después de la cuarta o quinta dosis consecutiva de la vacuna aP se ha observado en muchos otros estudios. En un estudio de 20 niños que experimentaron una gran hinchazón en las extremidades después de una cuarta dosis de la vacuna acelular, solo 4 tenían hinchazón en toda la parte superior del brazo después de una quinta dosis. Lo más común es que la hinchazón de toda la extremidad no se acompañe de dolor, enrojecimiento o malestar y se resuelve sin secuelas en unos pocos días; no se sabe si está relacionado con las extremidades utilizadas para vacunas anteriores. Más bien, hay evidencia que sugiere que la probabilidad de esta reacción está relacionada con los niveles de anticuerpos previos a la vacunación en el niño y la cantidad de antígeno en la vacuna.
En resumen, múltiples estudios han encontrado que las reacciones adversas ocurren con menos frecuencia (por lo general, sustancialmente menos) después de las vacunas acelulares en comparación con las vacunas wP. Las tasas de reacciones aumentan sucesivamente con cada dosis de refuerzo acelular, pero siguen siendo más bajas que las observadas entre los niños vacunados y reforzados con la vacuna de células enteras.
Vacunas contra la tos ferina acelular para adolescentes y adultos
La tolerabilidad enormemente mejorada de las vacunas aP, en comparación con las vacunas de células enteras, abrió la puerta a extender la vacunación contra la tos ferina más allá de la infancia. Se han evaluado numerosas vacunas aP en adolescentes y adultos y se ha demostrado que son seguras e inmunogénicas.
En reconocimiento de su menor contenido de antígenos de difteria y tos ferina, las formulaciones acelulares para adolescentes y adultos se denominan vacunas contra el tétanos, la difteria y la tos ferina (Tdap). Las vacunas Tdap desarrolladas por GlaxoSmithKline y Sanofi Pasteur están disponibles en todo el mundo, y recientemente se han autorizado vacunas Tdap adicionales en Asia (Bionet-Asia) o están en desarrollo (Serum Institute of India).
Un estudio patrocinado por NIH encontró que los componentes contra la tos ferina de 1 vacuna Tdap tienen una eficacia del 92 % (IC 95 %, 32 %–99 %) para prevenir la tos ferina, lo que cumple con la definición de caso primario. La vacuna aP fue bien tolerada; menos del 5% de los sujetos informaron reacciones adversas locales o sistémicas. Los grupos de estudio y control no difirieron en la tasa de eventos adversos graves. Asimismo, un estudio durante un brote de tos ferina entre estudiantes de secundaria australianos encontró una efectividad del 85 % para casos confirmados por laboratorio.
En 2005, poco después de la aprobación de las vacunas Tdap en EE. UU., el Comité Asesor sobre Prácticas de Inmunización (ACIP, por sus siglas en inglés) de EE. UU. recomendó una dosis de Tdap en lugar de la vacuna contra el tétanos y la difteria (Td) para todos los adolescentes (preferiblemente entre los 11 y los 12 años de edad) y adultos. Estudios posteriores demostraron el impacto beneficioso de esta vacuna Tdap sobre el riesgo o las tasas de tos ferina entre los adolescentes. Las recomendaciones actuales se analizan a continuación.
Vacunación en el embarazo: a pesar del éxito del programa de vacunación infantil contra la tos ferina y la introducción de la vacuna Tdap para adolescentes, las muertes por tos ferina entre los bebés de 0 a 3 meses de edad continuaron aumentando, de un total de 49 muertes durante los años 1980-1989 a 84 durante 1990-1999 y a 175 durante 2000–2009. El uso de Tdap para crear un "capullo de protección" alrededor de los recién nacidos mediante la vacunación de mujeres embarazadas o nuevas madres y otros contactos cercanos (padre, hermanos, abuelos, etc.) demostró ser efectivo cuando se implementó bien pero fue muy difícil de implementar bien. Estas dificultades estimularon el interés en el uso de Tdap durante el embarazo, pero se tuvieron que abordar 2 preocupaciones: la seguridad (tanto para la madre como para el feto) y la supresión potencial de las respuestas a la vacuna contra la tos ferina infantil (debido a los niveles elevados de anticuerpos tras placentarios). Después de que los estudios iniciales disiparon ambas preocupaciones, el ACIP en 2011 recomendó la administración de Tdap durante el embarazo. Numerosos estudios posteriores han demostrado la seguridad y eficacia de la vacuna Tdap durante el embarazo. La vacunación Tdap durante el embarazo proporciona al recién nacido altos niveles de anticuerpos maternos derivados de la placenta, lo que brinda protección durante el período de mayor riesgo, antes de que comience la serie de vacunación infantil. El aumento de anticuerpos tras placentarios reduce moderadamente las respuestas de anticuerpos del bebé a la primera y segunda dosis de DTaP para bebés, pero los niveles de anticuerpos después de la tercera y cuarta dosis se ven poco afectados. Dado que los primeros 3 meses de vida son, con mucho, los de mayor riesgo de morbilidad y mortalidad por tos ferina, esta es una compensación muy beneficiosa, como lo demuestran las recientes disminuciones en la tos ferina entre los bebés de 2 meses de edad y menores. Debido a la rápida disminución de los niveles de anticuerpos contra la tos ferina después de la Tdap, el ACIP recomendó en 2012 que las mujeres recibieran la Tdap durante cada embarazo, independientemente del momento de las vacunas anteriores. Muchos países han adoptado recomendaciones similares; por ejemplo, a partir de 2019, al menos 14 países de las Américas recomiendan la Tdap intraparto, al igual que el Reino Unido, Irlanda, Italia, Alemania, Suiza, Portugal, España, Bélgica, Nueva Zelanda y Australia, entre otros.
Reacciones adversas en adolescentes y adultos
Grandes ensayos clínicos de las vacunas Tdap entre adolescentes y adultos receptores de la vacuna de células completas mostraron que la adición de componentes aP purificados a la Td esencialmente no añadió nada al perfil de reacciones adversas. Varios estudios de seguridad muy grandes de Tdap en adolescentes y adultos no encontraron evidencia de eventos adversos importantes (incluidas reacciones neurológicas, reacciones alérgicas o enfermedades crónicas de nueva aparición). Los estudios en adolescentes y adultos no han encontrado que las reacciones adversas a la Tdap hayan aumentado significativamente por la vacunación reciente contra la tos ferina.
Duración de la protección para las vacunas contra la tos ferina aceular
Desde 2010, múltiples brotes grandes de tos ferina han demostrado tasas crecientes de tos ferina en adolescentes y escolares mayores que se correlacionan con la transición de aquellos cuya vacunación primaria fue completamente con vacuna de células enteras, a aquellos que inicialmente recibieron vacuna de células enteras y posteriormente vacuna acelular, a aquellos que recibieron solo vacuna acelular. Los estudios también han documentado un aumento en la actividad de la tos ferina a partir de los 7 años de edad entre las cohortes que recibieron solo vacunas acelulares y que la eficacia del refuerzo de Tdap para adolescentes ha disminuido más rápidamente entre los receptores solo de vacunas acelulares que entre las cohortes mayores que recibieron 1 o más dosis de la vacuna wP. Klein et al informaron en 2012 que después de la quinta dosis de la vacuna aP, las probabilidades de contraer la tos ferina aumentaron un promedio del 42 % por año. En 2019, Zerbo et al informaron que entre los niños vacunados con aP de 19 a 84 meses de edad, el riesgo de tos ferina fue 5 veces mayor 3 años en comparación con 1 año después de la última vacunación. Entre los niños vacunados de 7 a 11 años de edad, el riesgo fue el doble a los 6 años que a los 3 años después de la última vacunación. Una comparación de las epidemias de California de 2010 y 2014 ( Figura 1 ) encontró un papel cada vez mayor de los adolescentes mayores en la propagación del brote.
Estudios en modelos animales pueden explicar esto. Y el autor lo detalla en el original.
Un estudio de casos y controles realizado durante un brote en California en 2010 encontró que recibir las 5 dosis recomendadas de la vacuna aP tuvo una eficacia en general del 89 %; la eficacia disminuyó del 98 % en 1 año al 71 % 5 o más años después. Un estudio similar realizado durante el brote del estado de Washington de 2012 encontró que la eficacia de la Tdap entre los adolescentes fue del 73 % dentro del año posterior a la vacunación, pero disminuyó al 34 % entre los 2 y los 4 años posteriores a la vacunación. Del mismo modo, los datos del brote de Wisconsin de 2012 mostraron que los niños de 11 a 12 años jugaron el papel más importante en la propagación del brote.
Elección de vacunas
Las vacunas combinadas de múltiples componentes se utilizan normalmente para los programas de vacunación infantil en todo el mundo. Los programas públicos de vacunación en Europa, América del Norte, Australia, Nueva Zelanda y partes de Asia y América Latina utilizan vacunas que incorporan componentes aP; los fabricantes incluyen GlaxoSmithKline, MCM (Merck-Connaught-Merieux) Vaccine Company y Sanofi. Algunas jurisdicciones permiten que el proveedor elija entre productos alternativos disponibles; otros especifican un solo producto sobre la base de una licitación. El resto del mundo utiliza vacunas combinadas de múltiples componentes que contienen componentes wP, generalmente en forma de licitación; los fabricantes se encuentran casi en su totalidad en Asia e incluyen Biological E, LG Chemical, Panacea Biotech, PT Bio Farma y Serum Institute of India. Argentina vacuna con DPT a los 2, 4. 6 y 18 meses de edad, con un refuerzo a los 11 años, en el embarazo y a personal de salud, estos tres últimos con DTaP.
Recomendaciones
La vacuna contra la tos ferina se recomienda en todo el mundo para bebés y niños pequeños y se recomienda en muchos países para adolescentes, adultos, mujeres embarazadas y otros; los detalles están disponibles en los sitios web de la OMS.
En los Estados Unidos, el ACIP recomienda que todos los bebés reciban la vacuna contra la tos ferina a las edades de 2, 4 y 6 meses, 15 a 18 meses y 4 a 6 años. La vacuna Tdap se recomienda al menos una vez para cada persona de 11 años o más; Se han considerado los refuerzos periódicos de Tdap, pero no se han recomendado debido a la rápida disminución de los anticuerpos contra la tos ferina y la consiguiente baja rentabilidad. Sin embargo, ACIP recomendó recientemente que Tdap se puede usar siempre que se indique Td, lo que facilita la gestión del inventario de proveedores y permite el refuerzo decenal electivo de Tdap. Más importante aún, Tdap también se recomienda durante las semanas 27 a 36 de cada embarazo. En 2016, el Reino Unido modificó su recomendación materna de Tdap para incluir las semanas 20 a 32 de embarazo; esto ha reducido la incidencia de tos ferina entre los lactantes prematuros, sin efectos adversos sobre la protección de los lactantes nacidos a término. La vacuna contra la tos ferina está contraindicada en personas con antecedentes de anafilaxia o encefalopatía después de una vacuna previa contra la tos ferina.
Las recomendaciones son beneficiosas solo si se siguen. Aunque los sentimientos antivacunas han circulado desde la época de Jenner, el aumento global de la reticencia a las vacunas o el activismo antivacunas absoluto en las últimas décadas ha demostrado ser un desafío. A pesar de la abrumadora evidencia científica de que las vacunas previenen mucha más mortalidad y morbilidad de la que causan, cuando las personas no pueden ver personalmente los beneficios de la vacunación (enfermedades que no ocurrieron, muertes que no ocurrieron), es posible que solo vean riesgos, a menudo exagerados o inventados. Numerosos estudios han demostrado que evitar la vacunación, por lo general, a través de creencias personales o exenciones médicas injustificadas de los requisitos de vacunación para ingresar a la escuela, da como resultado un mayor riesgo de enfermedad, no solo para el niño no vacunado (insuficientemente) sino también para las personas a quienes ese niño expone,
Futuras vacunas
La incapacidad de las vacunas acelulares actuales para estimular los mismos tipos de respuestas inmunitarias celulares que se observan con las vacunas de células completas o las enfermedades naturales, y las consecuencias aparentes de esa diferencia con respecto a la durabilidad de la inmunidad y la protección contra el transporte y la transmisión, han estimulado muchos esfuerzos para desarrollar nuevas vacunas contra la tos ferina que conserven la seguridad de las vacunas acelulares actuales al tiempo que mejoran su respuesta inmunitaria celular. Aunque algunos han pedido un regreso a las vacunas tradicionales de células completas, eso claramente no sería aceptable para aquellos países que anteriormente tenían profundas preocupaciones sobre las reacciones adversas a las vacunas de células completas.
Los esfuerzos de desarrollo de vacunas se han dividido principalmente en 3 categorías: modificación de B. pertussis para su uso en vacunas de células completas con menor potencial de reacciones adversas; potenciación de las vacunas aP mediante la inclusión de antígenos de B. pertussis adicionales o diferentes , buscando respuestas inmunológicas similares a wP mientras conservan la seguridad similar a aP; y mejora de las vacunas aP mediante la adición de un adyuvante que impulsa las respuestas inmunitarias hacia el patrón observado con las vacunas wP. El ejemplo del primer enfoque ha sido el desarrollo de la variante de tos ferina BPZE1 B , construida mediante la inactivación genética o la eliminación de 3 toxinas principales. BPZE1 se administra por vía intranasal y se ha demostrado que protege contra la tos ferina pulmonar y nasal. Un ensayo clínico en voluntarios humanos demostró la seguridad y la capacidad de la vacuna para inducir la colonización en más del 80 % de los receptores, con seroconversión en el 100 % de los que recibieron la dosis más alta de la vacuna. Todos los vacunados tenían títulos elevados de IgG e IgA en sangre el día 28 y se detectaron células B de memoria específicas. La especificidad antigénica de estos anticuerpos, caracterizada por inmunotransferencia bidimensional, fue más amplia en comparación con el repertorio de anticuerpos de sujetos vacunados con aP y se dirigió predominantemente a antígenos que no estaban presentes en las vacunas aP. Se están realizando más estudios con esta vacuna.
Varios investigadores han seguido el segundo enfoque de mejorar las vacunas aP agregando antígenos de B. pertussis nuevos o diferentes. Varios investigadores han evaluado vesículas de membrana externa (OMV) de B. pertussis, que contienen múltiples antígenos, incluidos factores de virulencia secretados y unidos a la membrana. Una vacuna OMV desarrollada por Hozbor et al indujo inmunidad en ratones superior a la de aP y comparable a la de wP. También se está investigando la incorporación de antígenos nuevos o adicionales, incluidos factores de virulencia asociados a biopelículas, proteínas de captación de hierro, adenilato ciclasa u otras proteínas, así como el tratamiento con anticuerpos monoclonales.
La tercera alternativa que se está explorando implica la adición de nuevos adyuvantes para provocar una respuesta más sesgada hacia Th1. Por ejemplo, el grupo de Mills ha demostrado que la adición de un agonista del receptor tipo Toll (TLR)-7 a la vacuna aP mejora las respuestas Th1 y Th17 en ratones, lo que proporciona una protección después de la exposición comparable a la de las vacunas wP. También han desarrollado un nuevo adyuvante que combina un estimulador de interferón con un agonista de TLR-2 y han demostrado su capacidad para estimular las respuestas Th1 y Th17 y las células T residentes en tejidos intranasales. Otros adyuvantes que se están considerando incluyen el factor A de colonización de Bordetella, los agonistas CpG TLR-9 y los lipopolisacáridos.
Conclusiones
✔ En ausencia de una vacunación sistemática con la vacuna contra la tos ferina, prácticamente todas las personas padecerán tos ferina durante la infancia o la niñez; muchos sufrirán graves secuelas o morirán. ✔ Ninguna intervención médica está libre de riesgos, pero las vacunas modernas contra la tos ferina son efectivas y seguras; de hecho, mucho más seguras que evitar la vacunación. ✔ La tos ferina es una enfermedad endémica y altamente contagiosa; los brotes seguirán ocurriendo. En un brote, los niños vacunados tienen menos probabilidades de infectarse; si se infecta, la enfermedad será menos grave. ✔ Los niños no vacunados tienen un riesgo mucho mayor de infección y, si están infectados, tienen un riesgo mucho mayor de resultados adversos. ✔ Se están investigando varios enfoques para nuevas vacunas con una protección más duradera.
Referencias
Michael D Decker, Kathryn M Edwards, Pertussis (Whooping Cough), The Journal of Infectious Diseases, Volume 224, Issue Supplement_4, 1 October 2021, Pages S310–S320, https://doi.org/10.1093/infdis/jiaa469

%20Oxford%20Academic.png)




