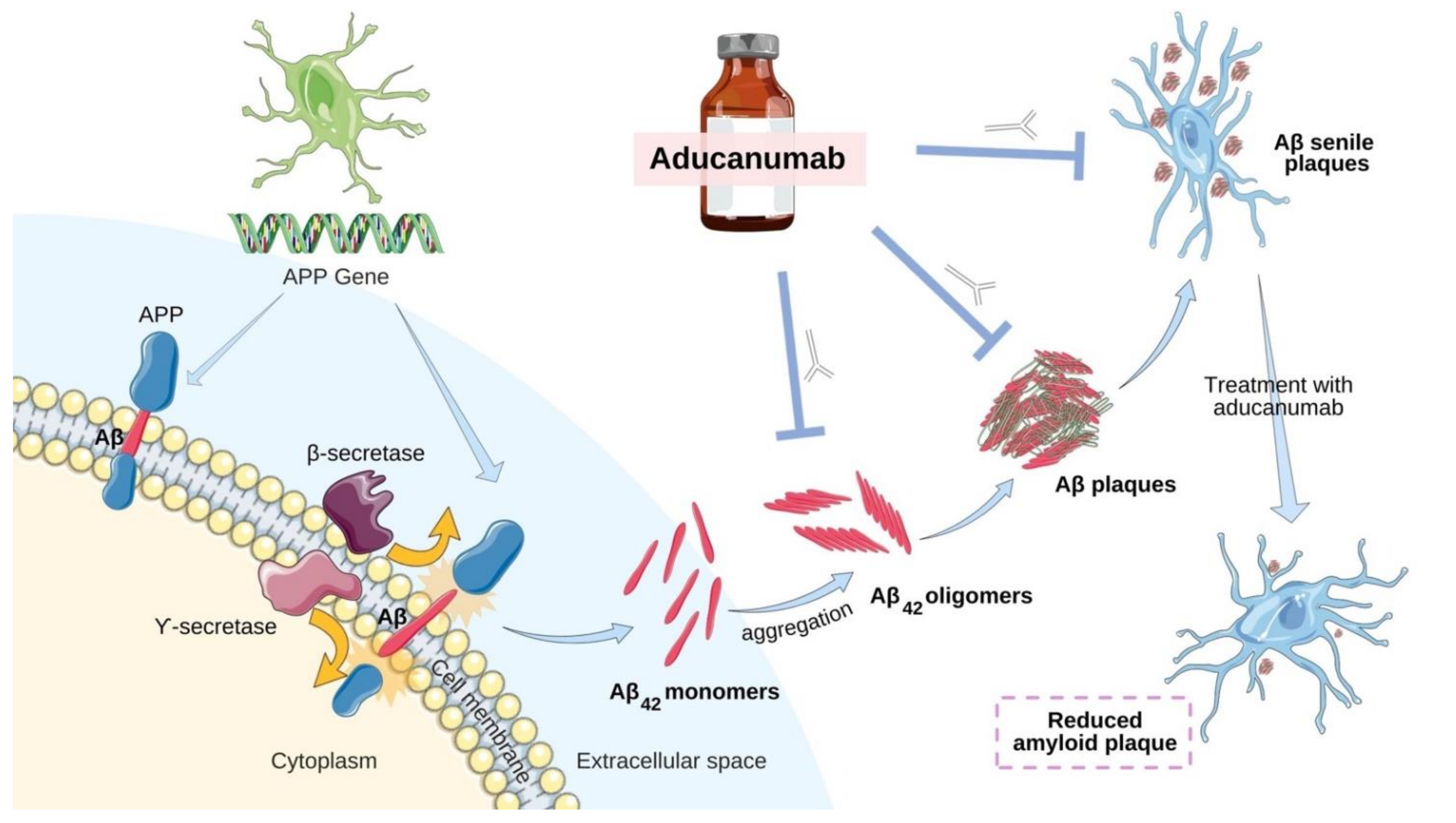
En Junio de 2021 la FDA aprobó un medicamento contra la enfermedad de Alzheimer, el aducanumab (Aduhelm® del laboratorio Biogen). Esto generó una extensa polémica no solo por el alto costo del medicamento, sino porque la aprobación se había realizado teniendo en cuenta que el fármaco promete una reducción del β.-amiloide cerebral, al que se acusa de estar involucrado en la fisiopatología de esta enfermedad. Hasta ahora la discusión aparece centrada en que esto es considerado una variable "subrogada" y no directa de la eficacia del fármaco. Es decir aprobados con evidencias orientadas a la enfermedad (Disease Oriented Evidence) vs la evidencia orientada al paciente (Problem Oriented Evidence that matters). El mismo British Medical Journal dedicó un extenso artículo escrito por dos investigadoras, Jeanne Lenzer y Sharon Brownlee, quienes expusieron los pro y contras de dicha decisión y el fármaco ya ha visto su rechazo en Europa y también en Canadá.
Pero esta polémica puede palidecer ante la noticia de que una investigación de 6 meses llevada adelante por la revista Science parece haber confirmado las sospechas del neurológo, e investigador en el área Matthew Schrag. El profesor Schrag habia sospechado que varias de las imágenes publicadas por investigadores, en donde se observaban los depósitos amiloides podian ser falsas. Un destacado analista de imágenes independiente y varios de los mejores investigadores de Alzheimer, incluidos George Perry de la Universidad de Texas, San Antonio, y John Forsayeth de la Universidad de California, San Francisco (UCSF), revisaron la mayoría de los hallazgos de Schrag a pedido de Science . Coincidieron con sus conclusiones generales, que arrojan dudas sobre cientos de imágenes, incluidas más de 70 en los artículos de Lesné, quien habia publicado un famoso artículo en el 2006. Algunos parecen ejemplos "sorprendentemente flagrantes" de manipulación de imágenes, dice Donna Wilcock, experta en Alzheimer de la Universidad de Kentucky.
El primer autor de ese influyente estudio, publicado en Nature en 2006 , fue un neurocientífico en ascenso: Sylvain Lesné de la Universidad de Minnesota. Su trabajo respalda un elemento clave de la hipótesis amiloide dominante pero controvertida del Alzheimer, que sostiene que los grupos de β-amiloides, conocidos como placas, en el tejido cerebral son la causa principal de la enfermedad devastadora, que afecta a decenas de millones en todo el mundo. En lo que parecía una prueba irrefutable de la teoría y una pista para posibles terapias, Lesné y sus colegas descubrieron un subtipo de β-amiloide y parecieron probar que causaba demencia en ratas. Si las dudas de Schrag son correctas, los hallazgos de Lesné fueron un elaborado espejismo.
A principios de este año Matthew Schrag planteó sus dudas ante algunas revistas, pero también ante el propio Instituto Nacional de Salud de los Estados Unidos, quienes han destinado cientos de millones de dólares a la investigación de la "hipótesis amiloide". El problema no es menor ya que se estima que el presupuesto destinado a estas investigaciones asciende a 1,600 millones de dólares.
Uno de sus mayores misterios de la enfermedad de Alzheimer también su característica más distintiva: las placas y otros depósitos de proteínas que el patólogo alemán Alois Alzheimer vio por primera vez en 1906 en el cerebro de un paciente fallecido con demencia. En 1984, la sustancia β-amiloide fue identificado como el principal componente de las placas. Y en 1991, los investigadores rastrearon el Alzheimer familiar hasta mutaciones en el gen de una proteína precursora de la que se deriva el amiloide. Para muchos científicos, parecía claro que la acumulación de esta sustancia desencadena una cascada de daño y disfunción en las neuronas, causando demencia. Detener los depósitos de amiloide se convirtió en la estrategia terapéutica más plausible.
El artículo de Nature del año 2006, de Lesne et al, ha sido citado en unos 2300 artículos académicos, más que todos los informes de investigación básica sobre el Alzheimer, excepto otros cuatro, publicados desde 2006, según la base de datos Web of Science. Desde entonces, el apoyo anual de los NIH para estudios etiquetados como "amiloide, oligómero y enfermedad de Alzheimer" aumentó de casi cero a $287 millones en 2021.
16 años después de publicado el estudio solo un puñado de los 2,300 artículos que lo citan, han confirmado los hallazgos, ya que parece ser que estos olígomeros son bastante inestables y se transforman espontáneamente en otros. Algunos investigadores señalan que varios otros laboratorios han intentado replicar sin éxito los hallazgos, pero no lo han publicado porque son poco interesantes para las revistas médicas que tienden a publicar hallazgos positivos y los investigadores suelen ser reacios a confrontar contra otros investigadores ya famosos.
En los últimos meses al menos se han corregido al menos dos de 20 artículos de Lesne que han sido cuestionados, pero aun asi persisten las dudas y la denuncia de la revista Science es trascendente, no solo por el prestigio de la revista, sino porque también se ha involucrado la opinión de varios científicos prestigiosos del área. También la revista Nature ha expresado su preocupación y otras revistas en donde se recibieron las publicaciones originales.
Una excepción fue Dennis Selkoe de la Universidad de Harvard, un destacado defensor de las hipótesis de los oligómeros tóxicos y amiloides, quien ha citado el artículo de Nature al menos 13 veces. En dos artículos de 2008, Selkoe dijo que no podía encontrar β-amiloide 56 en fluidos o tejidos humanos. Selkoe también afirma que algunas de las imagenes publicadas pudieran haber sido manipuladas. El mismo Selkoe hasta fue co-autor con Lesne de un artículo en Annals of Neurology en 2008 en el que se intentaron aislar algunos oligomeros tóxicos, pero no se pudo con el Aβ*56. Incluso una imágen de ese artículo fue reproducido en otros artículos de Lesné posteriormente. Algo que claramente es fraudulento.
La escasez de confirmación independiente de las afirmaciones de Aβ*56 parece reveladora, dice Selkoe. “En ciencia, una vez que publicas tus datos, si no se replican fácilmente, existe una preocupación real de que no sean correctos o verdaderos. Hay muy poca evidencia clara de que Aβ*56 existe, o si existe, se correlaciona de manera reproducible con las características de la enfermedad de Alzheimer, incluso en modelos animales”.
El mismo Schrag reconoce en Science que aun estos depósitos amiloides pueden jugar algún rol en la fisiopatología de la enfermedad de Alzheimer. Pero la historia de un eventual fraude sumado a la baja eficacia de los medicamentos que funcionan bajo esta "hipótesis amiloidea" hace repensar sus fundamentos.
Selkoe agrega que la hipótesis amiloide más amplia sigue siendo viable. “Espero que la gente no se desanime como resultado de lo que realmente parece un ejemplo muy atroz de malversación que está directamente en el campo del oligómero Aβ”, dice. Pero si los ensayos clínicos actuales de fase 3 de tres medicamentos dirigidos a los oligómeros amiloides fallan, señala, "la hipótesis Aβ está muy bajo presión".
La mayor preocupación de Selkoe, dice, es que el episodio de Lesné podría socavar aún más la confianza del público en la ciencia en un momento de creciente escepticismo y ataques. Pero los científicos deben demostrar que pueden encontrar y corregir casos raros de aparente mala conducta, dice. “Necesitamos declarar estos ejemplos y advertir al mundo”.
Estas noticias seguramente alegraran a quienes se oponen a la mayoría de los tratamientos farmacológicos que los médicos tenemos. Pero no debería ser nunca una buena noticia, para quienes creen que cada tropiezo en cualquier área de la ciencia, puede significar una demora en obtener tratamientos efectivos que muchas personas necesitan.
Artículos relacionados
Referencias
Charles Piller. Science.org. Retrieved July 24, 2022, from https://www.science.org/content/article/potential-fabrication-research-images-threatens-key-theory-alzheimers-disease
Should regulatory authorities approve drugs based on surrogate endpoints? doi:10.1136/bmj.n2059
Woloshin S, Kesselheim AS. What to Know About the Alzheimer Drug Aducanumab (Aduhelm). JAMA Intern Med. 2022;182(8):892. doi:10.1001/jamainternmed.2022.1039
No hay comentarios.:
Publicar un comentario